Jaką substancją jest woda?

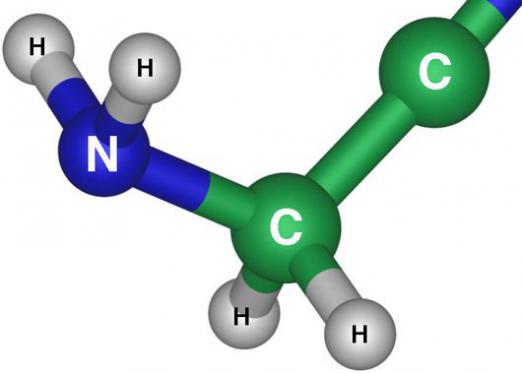
Woda jest związkiem nieorganicznym składającym się zz tlenu i wodoru. W normalnych warunkach jest to bezbarwny, przezroczysty płyn, który nie ma zapachu i smaku. W postaci stałej woda nazywa się śniegiem, lodem lub mrozem, a w postaci gazowej parą. Około 71% powierzchni planety pokrywa woda. Około 96% zasobów wodnych przypada na oceany, a pozostałe 4% pokrywają jeziora, lodowce, bagna i wody gruntowe. Ze swej natury woda jest doskonałym rozpuszczalnikiem i zawsze zawiera rozpuszczone substancje lub gazy w swoim składzie, z wyjątkiem wody destylowanej. Woda jest najważniejszym źródłem życia na naszej planecie. Dlatego w tym artykule postaramy się powiedzieć wszystko o tej niesamowitej substancji, a co najważniejsze, z jakiego rodzaju substancją woda pochodzi z natury i jakie są jej właściwości chemiczne i fizyczne.
Właściwości fizyczne wody
- W normalnych warunkach atmosferycznych wodazachowuje stan ciekły, a jednocześnie pozostałe związki wodorowe o podobnym planowaniu to gazy. Zjawisko to spowodowane jest szczególnymi właściwościami dodawania cząsteczek i atomów wody oraz wiązań między nimi. Atomy tlenu są przyłączone do atomów wodoru, tworząc kąt prawie 105 stopni, i ta konfiguracja jest zawsze zachowana. Dzięki dużej różnicy w elektroujemności atomów tlenu i wodoru chmury elektronów są silnie przesunięte w kierunku tlenu. W związku z tą przyczyną cząsteczka wody jest uważana za aktywny dipol, w którym strona wodorowa ma ładunek dodatni, a strona tlenowa jest ujemna. W rezultacie molekuła wody tworzy wiązania, jest dość trudna do rozbicia i wymaga dużo energii.
- Woda praktycznie nie nadaje się do wyciskania. Tak więc wraz ze wzrostem ciśnienia atmosferycznego o jeden bar, woda jest sprężana tylko o 0,00005 części, z pierwotnej objętości.
- Struktura lodu i wody jest bardzo podobna. Zarówno w lodzie, jak i w wodzie cząsteczki mają tendencję do osiadania w określonej kolejności - chcą tworzyć strukturę, ale uniemożliwia to ruch termiczny. Gdy woda zamienia się w stan stały, termiczna rotacja cząsteczek nie utrudnia już formowania strukturalnego, po czym cząsteczki są uporządkowane, a przestrzenie między nimi wzrastają, co w konsekwencji zmniejsza gęstość. To tłumaczy, że woda jest bardzo nienormalną substancją. Stały stan skupienia wody to lód, który może bezpiecznie unosić się na powierzchni ciekłego stanu skupienia wody. W przypadku parowania wszystkie połączenia są natychmiast przerywane. Łamanie tych wiązań wymaga znacznej ilości energii, co wyjaśnia największą pojemność cieplną wody wśród wszystkich substancji. Aby podgrzać litr wody o 1 stopień, musisz wydać około 4 kJ energii. Ze względu na tę właściwość woda jest często stosowana jako czynnik chłodzący.
- Woda ma wysokie napięcie powierzchniowe,uzyskując tylko rtęć w tym wskaźniku. Wysoka lepkość wody wynika z wiązań wodorowych, które uniemożliwiają cząsteczkom wykonywanie ruchów z różną szybkością.
- Woda jest dobrym rozpuszczalnikiem. Cząsteczki substancji rozpuszczonej są natychmiast otoczone cząsteczkami wody. Dodatnie cząstki substancji rozpuszczonej są przyciągane przez atomy tlenu, a cząsteczki ujemne są przyciągane przez atomy wodoru. Ponieważ wielkość cząsteczek wody jest wystarczająco mała, każda cząsteczka rozpuszczonej substancji może natychmiast otoczyć dużą liczbę cząsteczek wody.
- Woda jest substancją, która ma ujemny potencjał elektryczny powierzchni.
- W czystej postaci woda jest dobrym izolatorem,Ale ponieważ w nim często te lub inne substancje, sole lub kwasy się rozpuszczają, zawsze są jony ujemne i dodatnie w wodzie. Ze względu na te właściwości woda może przewodzić prąd.
- Współczynnik załamania światła wody wynosi n = 1,33. Jednak woda doskonale pochłania promieniowanie podczerwone, a w połączeniu z tą właściwością woda, a dokładniej para wodna, jest gazem cieplarnianym. Ponadto woda jest zdolna do pochłaniania promieniowania mikrofalowego, na którym opiera się działanie pieców mikrofalowych.
Właściwości chemiczne
Ci, którzy sądzą, że woda jest materią organiczną, są w błędzie. Woda składa się z dwóch pierwiastków - tlenu i wodoru. Następnie rozważamy główne chemiczne właściwości wody.
Możesz dostać wodę z następującymi reakcjami:
Również podczas reakcji zobojętniania:
Redukując tlenek miedzi za pomocą wodoru:
W temperaturze pokojowej woda reaguje:
Metale aktywne:
Ze związkami fluoru i halogenów:
Z solami utworzonymi przez słabą zasadę i słaby kwas, powodując ich hydrolizę:

- Z bezwodnikami halogenkowymi i bezwodnikami kwasów nieorganicznych i karboksylowych.
- Ze związkami metaloorganicznymi (odczynniki Grignarda, dietylocynek, metylosodowy).
- Z azotkami, węglikami, fosforem, wodorkami, krzemkami metali alkalicznych.
- W przypadku większości soli oprócz tworzenia się hydratów.
- Z silanami i boranami.
- Z węglem nokisyu i ketenem.
- Z fluorkami gazów szlachetnych.
Po podgrzaniu reaguje z magnezem, żelazo:
Z metanem i węglem:
W obecności katalizatorów reaguje:
- Z eterami i amidami.
- Z alkinami.
- Z nitrilami.
- Z alkenami.
Mam nadzieję, że nasz artykuł pomógł ci zrozumieć, czym jest woda, a teraz dowiesz się o niej więcej.